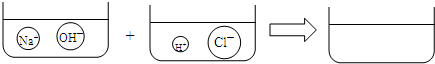
题目内容
要从BaCl2和NaOH混合固体中获得纯净的BaCl2,设计方案如下:
(1)方案一:将混合物溶于足量的水,过滤、蒸干.经分析该方案不合理,原因是 ________;
(2)方案二,将混合物溶于足量的水,再加入适量的CuCl2溶液,充分反应后过滤、蒸干.该方案也不合理的原因是 ________;
(3)合理的方案是:将混合物溶于足量的水,先用适量试剂①把BaCl2转化为含钡不溶物,过滤;再用足量试剂②将不溶物转化为BaCl2溶液,蒸干,便可以得到较纯净的BaCl2.所用试剂①和试剂②依次是 ________溶液和 ________溶液.
解:(1)氢氧化钠和氯化钡都溶于水,采用加水的方法无法分离除去氢氧化钠,故该方案不合理,所以本题答案为:氢氧化钠和氯化钡都溶于水;
(2)使用氯化铜溶液,可以与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,在除去氢氧化钠的同时又引入了新的杂质氯化钠,所以该方案不合理,所以本题答案为:除掉了氢氧化钠但又产生了氯化钠;
(3)先用适量试剂①把BaCl2转化为含钡不溶物,此含钡不溶物必须能重新转化为氯化钡,所以生成的沉淀应是碳酸钡沉淀,所以试剂①可以是碳酸钠,要使碳酸钡沉淀重新转化为氯化钡,可以加入稀盐酸,所以试剂②是稀盐酸,故本题答案为:碳酸钠,稀盐酸.
分析:要除去氢氧化钠获得纯净的氯化钡,需除去钠离子和氢氧根离子,但是钠离子不参与化学反应,故不易除去,所以可以考虑先使氯化钡转化为沉淀除去氢氧化钠,再将转化得到的沉淀重新转化为氯化钡.
点评:物质除杂题一般的原则是所选的试剂只与杂质反应且不引入新的杂质从而除去杂质,但是本题中的杂质由于含有的钠离子不参与化学反应很难除去,所以应反其道而行之,把原有的物质发生化学反应先转化为其他物质然后再加入试剂重新转化回来.同学们完成此题时,切不可思维定势.
(2)使用氯化铜溶液,可以与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,在除去氢氧化钠的同时又引入了新的杂质氯化钠,所以该方案不合理,所以本题答案为:除掉了氢氧化钠但又产生了氯化钠;
(3)先用适量试剂①把BaCl2转化为含钡不溶物,此含钡不溶物必须能重新转化为氯化钡,所以生成的沉淀应是碳酸钡沉淀,所以试剂①可以是碳酸钠,要使碳酸钡沉淀重新转化为氯化钡,可以加入稀盐酸,所以试剂②是稀盐酸,故本题答案为:碳酸钠,稀盐酸.
分析:要除去氢氧化钠获得纯净的氯化钡,需除去钠离子和氢氧根离子,但是钠离子不参与化学反应,故不易除去,所以可以考虑先使氯化钡转化为沉淀除去氢氧化钠,再将转化得到的沉淀重新转化为氯化钡.
点评:物质除杂题一般的原则是所选的试剂只与杂质反应且不引入新的杂质从而除去杂质,但是本题中的杂质由于含有的钠离子不参与化学反应很难除去,所以应反其道而行之,把原有的物质发生化学反应先转化为其他物质然后再加入试剂重新转化回来.同学们完成此题时,切不可思维定势.

练习册系列答案
相关题目
下表列出了部分酸、碱、盐在水中的溶解性(20℃)试从下表中选择物质回答:
(1)写出一种不溶于水但溶于酸的物质的化学式________;若要制取该物质,其化学方程式为________,该反应的基本类型为________反应.
(2)加一种物质均能除去下列各组物质中的杂质(括号内为杂质),这种物质是________.
①Cu(Fe2O3) ②Ag(Fe)
③HCl(BaCl2) ④NaCl[Ba(OH)2]
任写一个除去杂质时发生的化学方程式:________.
(3)现有两瓶无色的溶液,分别是烧碱(NaOH)溶液和纯碱(Na2CO3)溶液,小明分别用三种类别不同的物质为试剂,用三种方法加以鉴别.他选用的三种物质分别是________、________、________.
(4)纯净的烧碱由于敞口放置在空气中而含有杂质,可选用一种试剂,既可证明样品中含有杂质,又可将该杂质除去得到纯净的烧碱.其简要操作步骤为:________.
| 阴离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| 阳离子 | |||||
| H+ | ∥ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 溶 | 微 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 溶 | 微 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Ag+ | - | 溶 | 不 | 微 | 不 |
下表列出了部分酸、碱、盐在水中的溶解性(20℃)试从下表中选择物质回答:
(1)写出一种不溶于水但溶于酸的物质的化学式;若要制取该物质,其化学方程式为,该反应的基本类型为反应.
(2)加一种物质均能除去下列各组物质中的杂质(括号内为杂质),这种物质是.
①Cu(Fe2O3) ②Ag(Fe)
③HCl(BaCl2) ④NaCl[Ba(OH)2]
任写一个除去杂质时发生的化学方程式:.
(3)现有两瓶无色的溶液,分别是烧碱(NaOH)溶液和纯碱(Na2CO3)溶液,小明分别用三种类别不同的物质为试剂,用三种方法加以鉴别.他选用的三种物质分别是、、.
(4)纯净的烧碱由于敞口放置在空气中而含有杂质,可选用一种试剂,既可证明样品中含有杂质,又可将该杂质除去得到纯净的烧碱.其简要操作步骤为:.
(1)写出一种不溶于水但溶于酸的物质的化学式;若要制取该物质,其化学方程式为,该反应的基本类型为反应.
(2)加一种物质均能除去下列各组物质中的杂质(括号内为杂质),这种物质是.
①Cu(Fe2O3) ②Ag(Fe)
③HCl(BaCl2) ④NaCl[Ba(OH)2]
任写一个除去杂质时发生的化学方程式:.
(3)现有两瓶无色的溶液,分别是烧碱(NaOH)溶液和纯碱(Na2CO3)溶液,小明分别用三种类别不同的物质为试剂,用三种方法加以鉴别.他选用的三种物质分别是、、.
(4)纯净的烧碱由于敞口放置在空气中而含有杂质,可选用一种试剂,既可证明样品中含有杂质,又可将该杂质除去得到纯净的烧碱.其简要操作步骤为:.
| 阴离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| 阳离子 | |||||
| H+ | ∥ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 溶 | 微 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 溶 | 微 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Ag+ | - | 溶 | 不 | 微 | 不 |