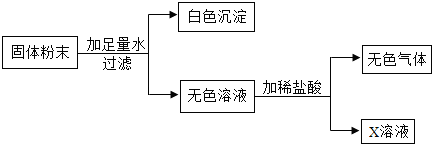
题目内容
一包白色粉末可能由碳酸钠、硫酸钠和氯化钠中的2种或3种组成.经实验得知其中肯定含有碳酸钠和硫酸钠.为了确定是否含有氯化钠,某同学设计了以下实验.请该同学的思路填写下表:
| 实验操作步骤 | 实验目的、现象及结论 |
| (1)取少量白色固体粉末,配成水溶液,向其中加入足量的稀酸A,A为_______ | 除去_________________________ |
| (2)继续加入足量的B,B为_______ | 除去硫酸钠 |
| (3)向(2)中的滤液中加入C,C为___溶液 | 若有_________,证明原白色固体粉末中肯定含有氯化钠;否则不含氯化钠 |
(1)因为碳酸钠与硝酸(或硫酸)反应,生成硝酸钠(硫酸钠)、水和二氧化碳气体,故A为HNO3(或H2SO4),可以除去Na2CO3;
(2)因为硝酸钡可与硫酸钠反应,生成硫酸钡沉淀和硝酸钠,故B为Ba(NO3)2,可以除去硫酸钠;
(3)因为硝酸银与氯化钠反应生成氯化银沉淀,故C为AgNO3,如有白色沉淀生成,则证明白色粉末中一定有氯化钠,否则不含氯化钠.
故答案为:(1)HNO3(或H2SO4),Na2CO3;(2)Ba(NO3)2;(3)AgNO3白色沉淀.
(2)因为硝酸钡可与硫酸钠反应,生成硫酸钡沉淀和硝酸钠,故B为Ba(NO3)2,可以除去硫酸钠;
(3)因为硝酸银与氯化钠反应生成氯化银沉淀,故C为AgNO3,如有白色沉淀生成,则证明白色粉末中一定有氯化钠,否则不含氯化钠.
故答案为:(1)HNO3(或H2SO4),Na2CO3;(2)Ba(NO3)2;(3)AgNO3白色沉淀.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目