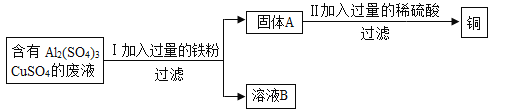
题目内容
【题目】高铁是中国制造的代表。

(1)建筑铁路所需的大量钢铁是以铁矿石为主要原料冶炼而得。请写出用一氧化碳和赤铁矿(主要成分Fe2 O3)炕铁的化学方程式______________
(2)高铁酸钠(Na2 FeO4)是高铁车厢内常用的一种“绿色环保高效”消毒剂,高铁酸钠中铁元素的化合价是_______
【答案】Fe2O3+3CO![]() 2Fe+3CO2 +6
2Fe+3CO2 +6
【解析】
(1)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。
(2)钠元素显+1价,氧元素显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价。
故答案为:
(1)Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)+6。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
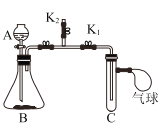
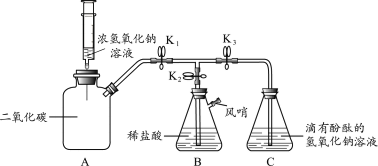
全优测试卷系列答案【题目】某同学利用图实验装置做了以下两个实验。
实验装置 | (实验一)研究燃烧条件 | (实验二)研究CO2与固体NaOH的反应 |
| 关闭K1和K2,在C中加入少量白磷,并加入热水浸没白磷。塞好胶塞,使导管口浸入热水中,发现白磷不燃烧;打开K2,将A中过氧化氢溶液滴入盛有MnO2的锥形瓶B中,马上关闭K2;打开K1,C中有气泡胃出,白磷立即燃烧 | 关闭K1和K2,A中盛有稀盐酸、B中盛放Na2CO3固体、C中是NaOH固体;打开K2,将A中液体滴人B中;一段时间后,用燃着的木条放在K2导管口,发现木条立即熄灭;再关闭K2,打开K1,待气球变鼓后,关闭K1,打开K2。 |
(1)实验一,锥形瓶B中发生的化学反应方程式为___。通过实验一可知,燃烧需要满足的一个条件是_______
(2)实验二,装药品前要检验B装置的气密性,需要进行的操作是_______
(3)两个实验中,气球分别所起的作用是_______
【题目】小明同学在做铝和稀盐酸反应时无意中加入几滴硫酸铜溶液,发现铝片表面产生气泡速率明显增快,对此他产生了兴趣。
(提出问题)硫酸铜溶液是不是此反应的催化剂?硫酸铜溶液的体积对此实验有影响吗?
(设计并实验)室温下,小明将过量、表面积相同已打磨的铝片分别加入到6份30mL10%稀盐酸中,并在每份中加入不同体积的硫酸铜饱和溶液,记录获得相同体积氢气的时间,从而确定产生氢气的速率。
实验混合溶液 | 1 | 2 | 3 | 4 | 5 | 6 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
水/mL | 20 | 19.5 | 17.5 | V | 10 | 0 |
(1)上述表格中V=______________。
(2)写出铝和稀盐酸反应的化学方程式:______________。
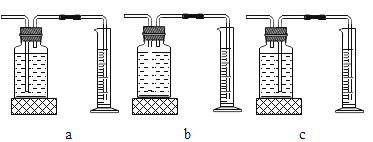
(3)定量收集氢气体积可用如图________(填写字母序号)装置。
(实验现象)随着硫酸铜溶液体积的增加,产生氢气的速率先加快后明显减慢,且铝片表面附着的红色物质逐渐增加。
(结论与解释)
(4)随着硫酸铜溶液体积的增加,反应速率明显变慢可能的原因是___
(5)根据实验现象小明认为硫酸铜溶液不是此反应的催化剂,其原因是___
(实验反思)加速铝和稀盐酸反应速率还可以采取的措施是___(写出一点)
(注意:若正确回答下列各题奖励4分,化学总分不超过60分)
(实验拓展)根据上述实验,小明认为是盐中的金属离子影响了铝和稀盐酸的反应速率;为了研究不同金属离子对反应的影响,小明同学继续实验,取过量表面积相同的铝片和30mL10%稀盐酸混合后加入不同的盐溶液,实验现象如表(加号越多,代表反应速率越快):
实验1 | 实验2 | 实验3 | 实验4 | ||
加入试剂0.5mL | 水 | 5%NaCl溶液 | 5%Mg2(NO)3溶液 | 5%FeSO4溶液 | 5%CuSO4溶液 |
产生气泡速率 | + | + | + | ++ | +++ |
(6)如表中,用水进行实验的目的是_________;
(7)上述实验设计存有缺陷,该缺陷是;改进实验后,仍符合上表中的实验现象,可得到的结论是:①______________;②______________.