题目内容
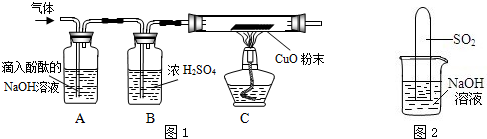
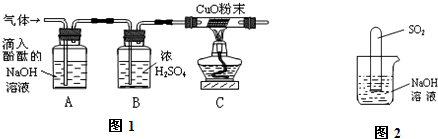
实验室中做H2还原CuO的实验时,还原8gCuO实际需消耗H2的质量( )
分析:氢气还原氧化铜的主要实验步骤是:先通氢,后加热;先停灯,再停氢.先通氢,后加热的目的是先排除试管中的空气,防止氢气和空气混合加热时发生爆炸;而先停灯,后停氢的目的是为防止生成的铜在高温下又被空气中的氧气氧化;因此根据实验过程不难看出,实际需要的氢气要比参与反应的氢气多很多.
解答:解:可设参与反应的氢气的质量为x.
H2+CuO
Cu+H2O
2 80
x 8g
=
x=
=0.2g
则根据实验过程可知,实际消耗的氢气的质量应远远大于0.2g,
故选A.
H2+CuO
| ||
2 80
x 8g
| 2 |
| 80 |
| x |
| 8g |
x=
| 2×8g |
| 80 |
则根据实验过程可知,实际消耗的氢气的质量应远远大于0.2g,
故选A.
点评:本题难度不是很大,主要考查了根据化学方程式的有关计算及氢气还原氧化铜的实验事项,从而培养学生对有关知识的理解.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目