题目内容
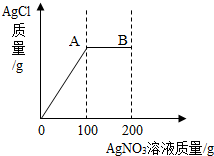 将2.34gNaCl固体溶于103.4g水中得到不饱和溶液,再向所得溶液中小心滴入200g AgNO3溶液.实验过程中,生成的AgCl的质量与滴入的AgNO3溶液的质量关系如图所示(提示:NaCl+AgNO3=AgCl↓+NaNO3 ).
将2.34gNaCl固体溶于103.4g水中得到不饱和溶液,再向所得溶液中小心滴入200g AgNO3溶液.实验过程中,生成的AgCl的质量与滴入的AgNO3溶液的质量关系如图所示(提示:NaCl+AgNO3=AgCl↓+NaNO3 ).(1)计算A点处生成NaNO3的质量?
(2)计算B点溶液中AgNO3的溶质质量分数?
(若最后结果不能整除,保留小数点后一位)
分析:(1)图中A点表示所加硝酸银与氯化钠恰好完全反应,根据反应的化学方程式,由参加反应氯化钠的质量计算此时生成硝酸钠的质量;
(2)图中A点硝酸银完全反应,据此计算出所用100g硝酸银溶液的溶质质量;到达B点时,溶液中硝酸银的质量为100g未反应硝酸银溶液中硝酸银的质量,利用质量守恒定律,可计算到达B点时所得溶液的质量,利用溶液中溶质质量分数公式计算B点溶液中AgNO3的溶质质量分数.
(2)图中A点硝酸银完全反应,据此计算出所用100g硝酸银溶液的溶质质量;到达B点时,溶液中硝酸银的质量为100g未反应硝酸银溶液中硝酸银的质量,利用质量守恒定律,可计算到达B点时所得溶液的质量,利用溶液中溶质质量分数公式计算B点溶液中AgNO3的溶质质量分数.
解答:解:(1)设A点处,反应AgNO3的质量为y,生成AgCl的质量为z,生成NaNO3的质量为x
AgNO3+NaCl=AgCl↓+NaNO3
170 58.5 143.5 85
y 2.34g z x
=
=
═
x=3.4g
y=6.8g
z=5.74g
由于溶液具有均一性,所以到A处硝酸银溶液中含有6.8g硝酸银,则B点的继续滴加的溶液中的硝酸银也是6.8g.
B点溶液的质量=2.34g+103.4g+200g-5.74g=300g
B点溶液AgNO3的溶质质量分数=
×100%=2.3%
答:A点处生成NaNO3的质量为3.4g,B点溶液AgNO3的溶质质量分数为2.3%.
AgNO3+NaCl=AgCl↓+NaNO3
170 58.5 143.5 85
y 2.34g z x
| 58.5 |
| 2.34g |
| 85 |
| x |
| 170 |
| y |
| 143.5 |
| z |
x=3.4g
y=6.8g
z=5.74g
由于溶液具有均一性,所以到A处硝酸银溶液中含有6.8g硝酸银,则B点的继续滴加的溶液中的硝酸银也是6.8g.
B点溶液的质量=2.34g+103.4g+200g-5.74g=300g
B点溶液AgNO3的溶质质量分数=
| 6.8g |
| 300g |
答:A点处生成NaNO3的质量为3.4g,B点溶液AgNO3的溶质质量分数为2.3%.
点评:分析变化图象的曲线时,曲线的折点表示反应恰好完全反应,折点后的线段表示所加溶液过量.

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目

 溶液的质量关系如下图所示(提示:NaCl + AgNO3 =" AgCl↓+" NaNO3)。
溶液的质量关系如下图所示(提示:NaCl + AgNO3 =" AgCl↓+" NaNO3)。

