题目内容
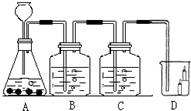
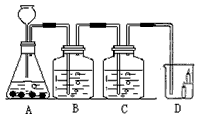
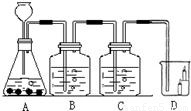
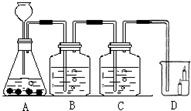
19、如图所示,B瓶盛有澄清的石灰水,C瓶盛有紫色石蕊试液,D杯有高低不同的燃着的蜡烛.回答下列问题:
(1)实验室制取二氧化碳的化学方程式为:
(2)图中有一处明显的错误是
改正错误后,C处能出现的现象
(3)D处现象为
(4)由D处现象可知二氧化碳的性质有:①
(5)志刚同学将A装置中反应后的剩余液体倒入肥皂水中,他能看到的现象是产生大量白色垢状物,泡沫少,试解释看到的现象

(1)实验室制取二氧化碳的化学方程式为:
CaCO3+2HCl=CaCl2+H2O+CO2↑
,(2)图中有一处明显的错误是
长颈漏斗没插入液面下;
,改正错误后,C处能出现的现象
紫色石蕊试液变红色;
,反应的化学方程式为 H2O+CO2=H2CO3;(3)D处现象为
低处蜡烛先熄灭,高处蜡烛后熄灭
;(4)由D处现象可知二氧化碳的性质有:①
二氧化碳不能燃烧
;②也不能支持燃烧
;(5)志刚同学将A装置中反应后的剩余液体倒入肥皂水中,他能看到的现象是产生大量白色垢状物,泡沫少,试解释看到的现象
反应后的溶液中有氯化钙,可认为是硬水
.分析:本题考查的是二氧化碳的制取,然后主要是验证二氧化碳的化学性质,同时验证了二氧化碳的密度比空气密度大这一物理性质.二氧化碳的三个化学性质是:①二氧化碳既不能燃烧也不能支持燃烧-用灭火验证②二氧化碳与石灰水反应-观察是否变浑浊③二氧化碳与水反应-用紫色石蕊试液验证.含有钙镁离子的水的硬水,能使肥皂水出现垢状物,不产生泡沫.
解答:解:(1)考查的是实验室制二氧化碳是反应原理,实验室用碳酸钙和稀盐酸反应制取二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)使用长颈漏斗制取气体时,长颈漏斗的下端一定要伸入液面以下,防止气体从长颈漏斗中散逸;二氧化碳与石蕊试液中的水反应生成碳酸,碳酸能使石蕊试液变红色.
(3)本小题既验证了二氧化碳的一个化学性质又验证了一个物理性质,二氧化碳能灭火因此蜡烛熄灭,下层的先熄灭,说明二氧化碳的密度比空气大.
(4)此实验可验证二氧化碳不燃烧,也不支持燃烧,密度比空气大;
(5)碳酸钙和盐酸反应生成氯化钙,氯化钙溶液能使肥皂水生成垢状物,可看做硬水.
故答案为:
(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)长颈漏斗没插入液面下;,紫色石蕊试液变红色;
(3)低处蜡烛先熄灭,高处蜡烛后熄灭;
(4)①二氧化碳不能燃烧;②也不能支持燃烧;
(5)反应后的溶液中有氯化钙,可认为是硬水.
(2)使用长颈漏斗制取气体时,长颈漏斗的下端一定要伸入液面以下,防止气体从长颈漏斗中散逸;二氧化碳与石蕊试液中的水反应生成碳酸,碳酸能使石蕊试液变红色.
(3)本小题既验证了二氧化碳的一个化学性质又验证了一个物理性质,二氧化碳能灭火因此蜡烛熄灭,下层的先熄灭,说明二氧化碳的密度比空气大.
(4)此实验可验证二氧化碳不燃烧,也不支持燃烧,密度比空气大;
(5)碳酸钙和盐酸反应生成氯化钙,氯化钙溶液能使肥皂水生成垢状物,可看做硬水.
故答案为:
(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)长颈漏斗没插入液面下;,紫色石蕊试液变红色;
(3)低处蜡烛先熄灭,高处蜡烛后熄灭;
(4)①二氧化碳不能燃烧;②也不能支持燃烧;
(5)反应后的溶液中有氯化钙,可认为是硬水.
点评:本题综合考查了二氧化碳的制取和性质,以及有关的现象和化学方程式的书写,考查的比较全面细致.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目