题目内容
质量相同的下列金属分别跟足量的盐酸作用,放出氢气最少的是( )
分析:根据选项中元素的相对原子质量和它们与稀盐酸反应的化学方程式,计算出1g这些金属分别与足量稀盐酸反应生成氢气的质量,再进行比较即可
解答:解:A、Zn的相对原子质量为65,65g锌可反应生成2g氢气,即1g锌生成
克氢气;
B、Al的相对原子质量为27,27g铝可反应生成3g氢气,即1g铝生成
克氢气;
C、Na的相对原子质量为23,23g钠可反应生成1g氢气,即1g钠生成
克氢气;
D、Mg的相对原子质量为24,24g镁可反应生成2g氢气,即1g镁生成
克氢气.
因为
>
>
>
,所以锌放出的氢气最少.
故选A.
| 1 |
| 32.5 |
B、Al的相对原子质量为27,27g铝可反应生成3g氢气,即1g铝生成
| 1 |
| 9 |
C、Na的相对原子质量为23,23g钠可反应生成1g氢气,即1g钠生成
| 1 |
| 23 |
D、Mg的相对原子质量为24,24g镁可反应生成2g氢气,即1g镁生成
| 1 |
| 12 |
因为
| 1 |
| 9 |
| 1 |
| 12 |
| 1 |
| 23 |
| 1 |
| 32.5 |
故选A.
点评:本题主要考查考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
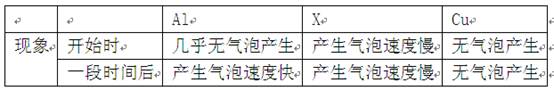
(4分)小强同学分别取溶质质量分数相同的稀盐酸,大小、形状都相同的某种金属X、Al、Cu 进行实验,实验现象记录如下
| | | Al | X | Cu |
| 现象 | 开始时 | 几乎无气泡产生 | 产生气泡速度慢 | 无气泡产生 |
| 一段时间后 | 产生气泡速度快 | 产生气泡速度慢 | 无气泡产生 |
(1)实验开始时,铝表面几乎无气泡产生的原因是 。
(2)Cu表面始终无气泡产生的原因是 。
(3)三种金属的活动性由强到弱的顺序是 。
(4)如果金属X的活动性比铁弱,且金属X与稀盐酸反应后生成易溶于水的XCl2。向只含有XCl2、CuCl2两种溶质的溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中加入稀盐酸,没有气泡产生。则滤液中一定含有的金属阳离子是 (用离子符号表示)。