题目内容
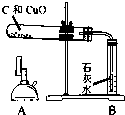
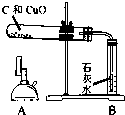
某同学在实验室进行了碳还原氧化铜的实验,实验步骤如下:
| 实验装置 | 实验步骤 | 分析 |
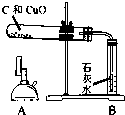 | ①检验装置气密性 | |
| ②把木炭和氧化铜的混合物放入试管,如左图所示连接实验装置 | 装置中存在的问题是______; | |
| ③改进装置后,点燃酒精喷灯开始实验 | 装置B的作用是______; | |
| ④反应结束时,先将导管从装置B中撤出,再停止加热 | 目的是______; | |
| ⑤待试管冷却后将剩余固体M倒入烧杯,加入足量稀硫酸,过滤 | 得到蓝色滤液 滤渣为红色和黑色固体混合物 |
(6)经测定实验⑤中氧化铜与稀硫酸反应共生成硫酸铜0.01mol,请计算固体M中有氧化铜多少摩尔?
解:(1)反应中要生成二氧化碳,且氢氧化钙的溶解能力有限,不能有效的吸收二氧化碳,而使气体不易排出而可能发生危险,故装置的错误为B装置不能有橡皮塞;
(2)根据反应中的生成物可以知道B中试剂的作用是用来检验是否生成二氧化碳的;
(3)如果先停止加热则会使试管中的气体由于温度降低而小于外界大气压,从而引起液体的倒流,所以为了防止液体倒流引起试管炸裂,所以应该先撤导管再熄灭酒精喷灯;
(4)根据碳和氧化铜反应的产物可以知道,在反应后的固体中除了碳和氧化铜外还有铜单质;
(5)在温度较高的条件下,铜可以和空气中的氧气反应而生成氧化铜,所以为了防止铜被氧气而通常是将试管内与外界隔开,等冷却后再打开橡皮塞;
(6)设参加反应的氧化铜的物质的量为x
CuO+H2SO4→CuSO4+H2O
1 1
x 0.01mol
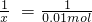
解得:x=0.01mol;
答:固体M中有0.01摩尔氧化铜.
故答案为:
(1)B试管处不应该有橡皮塞;
(2)检验产物是否有二氧化碳;
(3)防止液体倒流引起试管炸裂;
(4)铜;
(5)从试管B中撤出导管时,有空气进入试管,与灼热的铜再次反应生成氧化铜;
(6)0.01mol.
分析:(1)可以根据石灰水的溶解能力及生成物来完成解答;
(2)根据石灰水的性质及生成物来完成解答;
(3)如果先停止加热则会使试管中的气体由于温度降低而小于外界大气压,从而引起液体的倒流,可以据此答题;
(4)根据碳和氧化铜反应的产物来完成该题的解答;
(5)根据影响反应恰好完全反应的因素来解答该题;
(6)根据硫酸铜的质量结合氧化铜和硫酸反应的化学方程式来解答该题.
点评:本题是一道综合性实验探究题,对培养学生分析问题解决问题的能力有一定的提高,必须熟练掌握碳和氧化铜的反应及实验中的注意事项.
(2)根据反应中的生成物可以知道B中试剂的作用是用来检验是否生成二氧化碳的;
(3)如果先停止加热则会使试管中的气体由于温度降低而小于外界大气压,从而引起液体的倒流,所以为了防止液体倒流引起试管炸裂,所以应该先撤导管再熄灭酒精喷灯;
(4)根据碳和氧化铜反应的产物可以知道,在反应后的固体中除了碳和氧化铜外还有铜单质;
(5)在温度较高的条件下,铜可以和空气中的氧气反应而生成氧化铜,所以为了防止铜被氧气而通常是将试管内与外界隔开,等冷却后再打开橡皮塞;
(6)设参加反应的氧化铜的物质的量为x
CuO+H2SO4→CuSO4+H2O
1 1
x 0.01mol
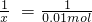
解得:x=0.01mol;
答:固体M中有0.01摩尔氧化铜.
故答案为:
(1)B试管处不应该有橡皮塞;
(2)检验产物是否有二氧化碳;
(3)防止液体倒流引起试管炸裂;
(4)铜;
(5)从试管B中撤出导管时,有空气进入试管,与灼热的铜再次反应生成氧化铜;
(6)0.01mol.
分析:(1)可以根据石灰水的溶解能力及生成物来完成解答;
(2)根据石灰水的性质及生成物来完成解答;
(3)如果先停止加热则会使试管中的气体由于温度降低而小于外界大气压,从而引起液体的倒流,可以据此答题;
(4)根据碳和氧化铜反应的产物来完成该题的解答;
(5)根据影响反应恰好完全反应的因素来解答该题;
(6)根据硫酸铜的质量结合氧化铜和硫酸反应的化学方程式来解答该题.
点评:本题是一道综合性实验探究题,对培养学生分析问题解决问题的能力有一定的提高,必须熟练掌握碳和氧化铜的反应及实验中的注意事项.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
 35、某同学在实验室进行了如图所示的实验.
35、某同学在实验室进行了如图所示的实验.