题目内容
 我市天山汉墓出土青铜器表面一些有绿色物质,该物质俗称“铜绿”,其化学组成为Cu2(OH)2CO3.小明同学研究该物质时做了下列实验.
我市天山汉墓出土青铜器表面一些有绿色物质,该物质俗称“铜绿”,其化学组成为Cu2(OH)2CO3.小明同学研究该物质时做了下列实验.
实验一:取2.22g“铜绿”固体,向其中加入足量的7.3%的稀盐酸,使固体完全溶解.反应方程式为:
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O,试求参加反应的稀盐酸的质量.
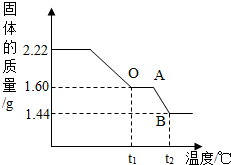
实验二:(1)另取2.22g“铜绿”固体加热使其分解,绘制出固体的质量随温度的变化关系图.如图到t1℃时全部变为黑色固体,则此过程中生成的二氧化碳和水的总质量为________g.
(2)根据上图,计算并推理出升温到t2℃后,BC段残留固体的合理化学式(要求有计算过程).
实验一:解:设参加反应的稀盐酸的质量为x
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 146
2.22g 7.3%x
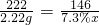
x=20g
答:参加反应的稀盐酸的质量为20g
实验二:(1)生成的二氧化碳和水的总质量=2.22g-1.60g=0.62g;
故答案为:0.62
(2)解:根据图中数据知:从t1℃到t2℃固体的质量减少:1.60g-1.44g=0.16g
t1℃时1.60g氧化铜中铜元素质量=1.60g×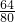 =1.28g
=1.28g
t1℃时1.60g氧化铜中氧元素质量=1.60g× =0.32g
=0.32g
因为:BC段固体中氧元素质量为:0.32g-0.16g=0.16g,
所以,BC段固体中铜、氧元素质量比=1.28g:0.16g=8:1
设BC段固体的化学式为CuxOy,
则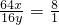
x:y=2:1
所以BC段时固体化学式为Cu2O.
答:BC段残留固体的化学式为Cu2O.
分析:实验一:根据化学方程式和质量守恒定律计算参加反应的稀盐酸的质量.
实验二:(1)根据“铜绿”分解的化学方程式Cu2(OH)2CO3 2CuO+H2O+CO2↑可知,全部变为黑色固体,就是生成CuO的质量,根据质量守恒定律,则生成的二氧化碳和水的总质量=“铜绿”的质量-生成CuO的质量;
2CuO+H2O+CO2↑可知,全部变为黑色固体,就是生成CuO的质量,根据质量守恒定律,则生成的二氧化碳和水的总质量=“铜绿”的质量-生成CuO的质量;
(2)分析图示数据和已知条件可知,t1℃时1.60g氧化铜中氧元素质量-从t1℃到t2℃固体的质量减少的质量=BC段固体中氧元素质量;t1℃时1.60g氧化铜中铜元素质量=t1℃时1.60g氧化铜×氧化铜中铜元素的质量分数;然后根据两者的质量比,计算出铜和氧的个数比,即可写出BC段时固体化学式.
点评:解决这类试题要抓住三点(1)抓住“三点一趋势“即起点、转折点、终点和图象的变化趋势;(2)分析出图象中所给数据的意义;(3)正确运用有关数据解决问题.
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 146
2.22g 7.3%x
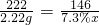
x=20g
答:参加反应的稀盐酸的质量为20g
实验二:(1)生成的二氧化碳和水的总质量=2.22g-1.60g=0.62g;
故答案为:0.62
(2)解:根据图中数据知:从t1℃到t2℃固体的质量减少:1.60g-1.44g=0.16g
t1℃时1.60g氧化铜中铜元素质量=1.60g×
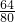 =1.28g
=1.28gt1℃时1.60g氧化铜中氧元素质量=1.60g×
 =0.32g
=0.32g因为:BC段固体中氧元素质量为:0.32g-0.16g=0.16g,
所以,BC段固体中铜、氧元素质量比=1.28g:0.16g=8:1
设BC段固体的化学式为CuxOy,
则
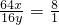
x:y=2:1
所以BC段时固体化学式为Cu2O.
答:BC段残留固体的化学式为Cu2O.
分析:实验一:根据化学方程式和质量守恒定律计算参加反应的稀盐酸的质量.
实验二:(1)根据“铜绿”分解的化学方程式Cu2(OH)2CO3
 2CuO+H2O+CO2↑可知,全部变为黑色固体,就是生成CuO的质量,根据质量守恒定律,则生成的二氧化碳和水的总质量=“铜绿”的质量-生成CuO的质量;
2CuO+H2O+CO2↑可知,全部变为黑色固体,就是生成CuO的质量,根据质量守恒定律,则生成的二氧化碳和水的总质量=“铜绿”的质量-生成CuO的质量;(2)分析图示数据和已知条件可知,t1℃时1.60g氧化铜中氧元素质量-从t1℃到t2℃固体的质量减少的质量=BC段固体中氧元素质量;t1℃时1.60g氧化铜中铜元素质量=t1℃时1.60g氧化铜×氧化铜中铜元素的质量分数;然后根据两者的质量比,计算出铜和氧的个数比,即可写出BC段时固体化学式.
点评:解决这类试题要抓住三点(1)抓住“三点一趋势“即起点、转折点、终点和图象的变化趋势;(2)分析出图象中所给数据的意义;(3)正确运用有关数据解决问题.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
教材p32学生实验:探究铁、铜、银三种金属活动性强弱.以下是小强同学的实验方案,我们一起对实验分析、完善並归纳.
[实验药品]铁片、铜片、银片、20%稀硫酸、CuSO4溶液、AgNO3溶液、FeSO4溶液
[提出假设]三种金属的活动性强弱为:Fe>Cu>Ag
[实验方案]取体积相等的金属片,用砂纸打磨光亮;分别进行下列实验操作.
| 序号 | 步骤Ⅰ | 步骤Ⅱ | |||
| 实验 操作 | 将铁片、铜片和银片分别放入盛有溶质质量分数相同、体积相同的稀硫酸的试管中 | 将铁片分别放入盛有溶质质量分数相同、体积相同的CuSO4溶液和AgNO3溶液的试管中 | |||
 |  |  |  |  | |
| A | B | C | D | E | |
①上述实验中能观察到金属表面有气泡产生是________(填字母A、B、C).
②我国古代“湿法炼铜”就是利用了实验试管D中的反应原理,请写出该反应化学方程式________.该反应属于________反应(填:基本反应类型).
[方案完善]通过上述实验还不能证明铁、铜、银三种金属的活动性强弱,请你在此基础上补充一个实验帮助小强达到实验目的.
| 实验操作步骤 | 实验现象 | 结论 |
a.________;b.________.
