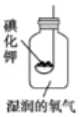
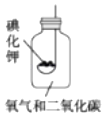
题目内容
【题目】地球深处的水处于超临界状态,称为超临界水,如图为某压强下CaCl2和NaCl在超临界水中的溶解度曲线,该压强下,下列说法正确的是( ) 
A.在超临界水中,NaCl的溶解度大于CaCl2的溶解度
B.在超临界水中,2种物质的溶解度都随温度升高而增大
C.450℃时,NaCl在超临界水中的溶解度为0.04g
D.450℃时,可得到0.04%的CaCl2的超临界水溶液
【答案】C
【解析】解:A、在比较物质物质的溶解度时,需要指明温度,故A错误; B、通过分析溶解度曲线可知,在超临界水中,2种物质的溶解度都随温度升高而减小,故B错误;
C、通过分析溶解度曲线可知,450℃时,NaCl在超临界水中的溶解度为0.04g,故C正确;
D、通过分析溶解度曲线可知,450℃时,NaCl在超临界水中的溶解度为0.04g,饱和溶液的溶质质量分数为: ![]() ×100%,故D错误.
×100%,故D错误.
故选:C.
【考点精析】利用固体溶解度曲线及其作用和溶质的质量分数、溶解性和溶解度的关系对题目进行判断即可得到答案,需要熟知1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和);溶质质量分数 =溶质质量/溶液质量*100% ;溶解度=溶质质量/溶剂质量*100g (必须选取饱和溶液);溶液质量=溶质质量(克)+溶剂质量(克) ;对于饱和溶液,溶液质量分数w = S/(S+100);所以溶解度S = 100/(1/w-1).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应). 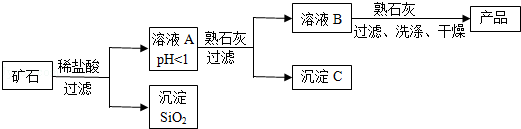
请回答下列问题:
(1)溶液A中共含有种阳离子;写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式(只写一个)
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀,该实验条件下,使金属阳离子沉淀的相关pH数据见表.为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可允许的范围为是;
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 8.6 |
完全沉淀的pH | 3.2 | 6.7 | 11.1 |
(3)写出溶液B中加入熟石灰发生的化学反应方程式 .