题目内容
对下列说法判断的结果是
①在一溶液中滴入石蕊试液,呈红色,该溶液中无H+
②HCl,H2S和NH3 都是非金属元素跟氢的化合物,都属于无氧酸
③中性溶液中,既没有H+也没有OH-
④溶液pH 越大,H+浓度越大,溶液性越强
⑤10 g 10%的盐酸和10 g 10%的NaOH溶液充分混合后,溶液呈中性,pH=7
⑥将pH=5和pH=4的溶液混合,混合后溶液的pH=9.
A.只有①正确
B.只有②③正确
C.只有⑤⑥正确
D.都不正确
解析:
|
解题指导:NH3既不是酸也不是碱.能使石蕊试液呈红色的溶液为酸性溶液,其中一定含有H+.水溶液中,无论酸性、碱性、中性都是既有H+又有OH-(极少量水电离产生的),只是它们浓度大小不同而已,如H+浓度大于OH-浓度,则溶液的pH<7.pH越小,H+浓度越大,溶液酸性越强.pH=5和pH=4的溶液都是酸性溶液,混合后仍是酸性溶液,pH仍小于7(介于4~5). 盐酸与NaOH溶液混合时,发生中和反应:NaOH+HCl |

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案某校九年级(1)、(2)两班同学做常见酸和碱与指示剂反应的实验,使用的试剂如图所示,
实验后废液分别集中到废液缸中。某研究小组对此废液进行了检测,结果如下表:
| 废液来源 | 检测方法 | 观察到的现象 |
| (1)班 | 观察废液颜色 | 废液呈无色 |
| (2)班 | 观察废液颜色 | 废液呈红色 |
请你根据以上实验现象判断,下列对该废液成分的说法中.错误的是 ( )
A.(1)班实验后的废液中可能含有盐酸 B.(1)班废液中一定含有的物质只有氯化钠
C.(2)班实验后的废液成分中肯定没有盐酸 D.(2)班实验后的废液中可能含有氢氧化钠
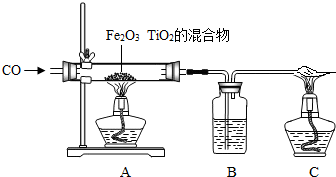
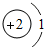 D.原子结构示意图为
D.原子结构示意图为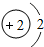

 D.原子结构示意图为
D.原子结构示意图为