题目内容
氯化钠既是重要的调味品,又是重要的工业原料.
①实验室里有一小袋粗盐,其中含有较多的可溶性杂质(MgCl2、CaCl2等)和泥沙等不溶性杂质,要初步提纯这袋粗盐需要经过的步骤是溶解、过滤和________.若要计算提纯后所得精盐的产率.必须用的仪器是________.
②工业上用给饱和食盐水通电的方法可制得一种碱R和氢气、氯气,化学方程式为:
2NaCl+2H2O 2R+H2↑+Cl2↑,其中R的化学式为________,若反应中消耗了58.5g氯化钠,则理论上可得到R的质量为________g.
2R+H2↑+Cl2↑,其中R的化学式为________,若反应中消耗了58.5g氯化钠,则理论上可得到R的质量为________g.
蒸发 天平 NaOH 40
分析:①根据氯化钠的溶解度受温度影响变化较小,要得到晶体,需要蒸发溶剂进行分析,要计算产率就必须知道精盐的质量,根据实验室称量固体的质量分析选用的仪器.
②根据质量守恒定律的微观解释进行分析,根据方程式中的比例关系进行分析.
解答:①经过过滤后,氯化钠都在溶液中,要得到氯化钠晶体,就需要蒸发溶剂使晶体析出,故答案为:蒸发;
要称量固体的质量就需要用到天平,故答案为:天平,
②根据反应前后的原子个数保持不变,故答案为:NaOH;
由方程式可知,氢氧化钠和氯化钠进行中和反应时,是按照40:58.5的比例关系进行反应的,故答案为:40.
点评:在解方程式中化学式的推断时,主要是根据质量守恒定律中提到的反应前后的原子个数不变,确定化学式中的原子个数,再根据化合价书写化学式.
分析:①根据氯化钠的溶解度受温度影响变化较小,要得到晶体,需要蒸发溶剂进行分析,要计算产率就必须知道精盐的质量,根据实验室称量固体的质量分析选用的仪器.
②根据质量守恒定律的微观解释进行分析,根据方程式中的比例关系进行分析.
解答:①经过过滤后,氯化钠都在溶液中,要得到氯化钠晶体,就需要蒸发溶剂使晶体析出,故答案为:蒸发;
要称量固体的质量就需要用到天平,故答案为:天平,
②根据反应前后的原子个数保持不变,故答案为:NaOH;
由方程式可知,氢氧化钠和氯化钠进行中和反应时,是按照40:58.5的比例关系进行反应的,故答案为:40.
点评:在解方程式中化学式的推断时,主要是根据质量守恒定律中提到的反应前后的原子个数不变,确定化学式中的原子个数,再根据化合价书写化学式.

练习册系列答案
相关题目
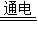 2R+H2↑+Cl2↑,其中R的化学式为______,若反应中消耗了58.5g氯化钠,则理论上可得到R的质量为______g.
2R+H2↑+Cl2↑,其中R的化学式为______,若反应中消耗了58.5g氯化钠,则理论上可得到R的质量为______g. 2R+H2↑+Cl2↑,其中R的化学式为______,若反应中消耗了58.5g氯化钠,则理论上可得到R的质量为______g.
2R+H2↑+Cl2↑,其中R的化学式为______,若反应中消耗了58.5g氯化钠,则理论上可得到R的质量为______g. 2R+H2↑+Cl2↑,其中R的化学式为__________,若反应中消耗了58.5g氯化钠,则理论上可得到R的质量为___g。
2R+H2↑+Cl2↑,其中R的化学式为__________,若反应中消耗了58.5g氯化钠,则理论上可得到R的质量为___g。