题目内容
【题目】如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题。
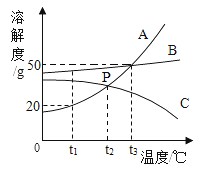
(1)在t1℃时,将20gA物质加入到50g水中充分溶解,得到溶液的质量为_____。
(2)将t3℃时A、B、C三种物质的饱和溶液降温到t2℃,所得三种溶液中溶质的质量分数大小关系是______。
(3)若A中混有少量B时,最好采用______方法提纯A。
【答案】60g B>A>C 降温结晶
【解析】
(1)在t1℃时,A物质的溶解度是20g,所以将20gA物质加入到50g水中,充分溶解,得到溶液的质量为60g;
(2)t2℃时,B物质的溶解度最大,A、C物质的溶解度相等,降低温度,A、B物质的溶解度减小,C物质的溶解度增大,应该按照t3℃时的溶解度计算,所以将t3℃时A、B、C三种物质的饱和溶液降温到t2℃,此时三种溶液中溶质的质量分数大小关系是:B>A>C;
(3)A物质的溶解度受温度变化影响较大,所以若A中混有少量B时,最好采用降温结晶方法提纯A。

练习册系列答案
相关题目
【题目】实验室现有氯化镁和氯化钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数,先称取该混合物样品20g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液200g平均分四次加入其中,充分振荡,实验所得数据见下表。
请你分析并进行有关计算:(提示:氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠)
次数 | 1 | 2 | 3 | 4 |
加入氢氧化钠溶液的质量/g | 50 | 50 | 50 | 50 |
生成沉淀的质量/g | 2.9 | x | 8.7 | 8.7 |
(1)第_____次氯化镁和氢氧化钠刚好完全反应。
(2)原固体混合物样品中氯化镁的质量分数是多少?_____(要求有完整的计算过程)