题目内容
某同学在实验室发现一瓶NaOH溶液密封不严,他怀疑已部分变质.为了定性 地判断该液中是否存在Na2CO3,请你帮助完成他设计两种不同的实验方案.方案一(3分):
| ①提出设想 | BaCl2与NaOH不反应,与Na2CO3会生成白色沉淀. |
| ②选用仪器 | ______ |
| ③进行实验 | 用试管(或烧杯)分别取少量样品溶液,再______. |
| ④反应现象和结论 | 如果溶液中出现白色沉淀,则样品中存在Na2CO3,NaOH溶液已变质;如果溶液中无白色沉淀出现,则______,溶液未变质. |
| ①提出设想 | 酸与NaOH反应______,与Na2CO3______. |
| ②选用仪器 | ______ |
| ③进行实验 | ______ |
| ④反应现象 和结论 | 如果______,则样品中有Na2CO3,NaOH溶液已变质; 如果______,则样品中无Na2CO3,NaOH溶液未变质. |
答:______.
【答案】分析:证明NaOH溶液是否部分变质,就是证明其中是否存在Na2CO3,可根据碳酸钠与氯化钡溶液反应是否产生白色沉淀,与酸反应是否产生气泡来判断是否变质.
常温下溶液之间的反应实验操作,一般用试管(用来盛放液体)和胶头滴管(用来向试管中滴加另一种液体)就可完成实验.
在完成方案二的实验报告时借助方案一可以顺利完成;
当向碳酸钠和氢氧化钠的混合溶液中加入酸时,碱要先反应,碱反应完全后碳酸钠才反应.
解答:解:方案一:因为碳酸钠和氯化钡溶液反应产生白色的碳酸钡沉淀,而氢氧化钠溶液和氯化钡溶液不反应,所以可用试管取样品少许,用胶头滴管吸取氯化钡溶液,滴入试管中,若产生白色沉淀,则证明碳酸钠存在,样品变质;若无沉淀产生,证明碳酸钠不存在,样品未变质.
故答案为:
方案二:因为碳酸钠和盐酸反应有二氧化碳气体放出,可以看到有气泡产生,而氢氧化钠和盐酸反应没有明显现象,所以可以用试管取样品少许,用胶头滴管吸取少量盐酸,滴入试管中,若产生气泡,则证明碳酸钠存在,样品变质,若没有气泡产生,则证明碳酸钠不存在,样品未变质.
故答案为:
设问:因为氢氧化钠的碱性强于碳酸钠,当向碳酸钠和氢氧化钠的混合溶液中滴加酸时,氢氧化钠先和酸反应,氢氧化钠反应完全后,碳酸钠再与滴入的酸反应,有气泡产生;当把碳酸钠和氢氧化钠的混合溶液滴入酸中时,由于酸是过量的,所以一开始就有气泡产生.
故答案为:将向酸中滴入样品溶液时立即有气泡放出;向样品中滴入酸过一会儿才有气泡(或开始无气泡,后来才有气泡)
点评:熟练掌握氢氧化钠、碳酸钠的性质是解题的关键,本题通过药品是否变质的探究培养了学生的实验探究能力.
碳酸钠和氯化钡、氢氧化钙及盐酸的反应原理、反应现象是初中十分重要的内容,是中考中经常出现的重要知识点,平时要注意整理.
常温下溶液之间的反应实验操作,一般用试管(用来盛放液体)和胶头滴管(用来向试管中滴加另一种液体)就可完成实验.
在完成方案二的实验报告时借助方案一可以顺利完成;
当向碳酸钠和氢氧化钠的混合溶液中加入酸时,碱要先反应,碱反应完全后碳酸钠才反应.
解答:解:方案一:因为碳酸钠和氯化钡溶液反应产生白色的碳酸钡沉淀,而氢氧化钠溶液和氯化钡溶液不反应,所以可用试管取样品少许,用胶头滴管吸取氯化钡溶液,滴入试管中,若产生白色沉淀,则证明碳酸钠存在,样品变质;若无沉淀产生,证明碳酸钠不存在,样品未变质.
故答案为:
| ①提出设想 | |
| ②选用仪器 | 试管(或小烧杯)、胶头滴管 |
| ③进行实验 | 用胶头滴管吸取少量BaCl2溶液滴入样品溶液中 |
| ④反应现象和结论 | 样品中不存在Na2CO3 |
故答案为:
| ①提出设想 | 无气泡,有气泡放出 |
| ②选用仪器 | 试管(或小烧杯)、胶头滴管 |
| ③进行实验 | 用试管(或烧杯)取少量盐酸,再用胶头滴管吸取少量样品溶液滴入试管(或烧杯中) |
| ④反应现象和结论 | 有气泡放出 无气泡放出 |
故答案为:将向酸中滴入样品溶液时立即有气泡放出;向样品中滴入酸过一会儿才有气泡(或开始无气泡,后来才有气泡)
点评:熟练掌握氢氧化钠、碳酸钠的性质是解题的关键,本题通过药品是否变质的探究培养了学生的实验探究能力.
碳酸钠和氯化钡、氢氧化钙及盐酸的反应原理、反应现象是初中十分重要的内容,是中考中经常出现的重要知识点,平时要注意整理.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 某同学在实验室发现一瓶标签残缺(如下图所示)的溶液.为了测定此溶液的溶质质量分数,他取出100g该溶液,向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示.
某同学在实验室发现一瓶标签残缺(如下图所示)的溶液.为了测定此溶液的溶质质量分数,他取出100g该溶液,向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示.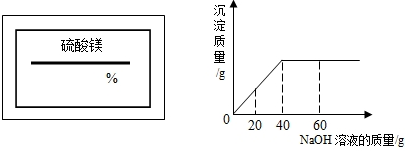
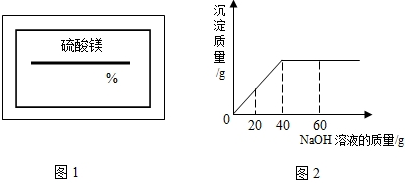
 (2009?南开区一模)某同学在实验室发现一瓶标签残缺的硫酸镁溶液.为了测定此溶液的溶质质量分数,他取出25g该溶液,向其中逐滴加入溶质质量分数为10%的NaOH溶液.反应过程中生成沉淀的质量与所用NaOH溶液质量的关系如图所示.试求:
(2009?南开区一模)某同学在实验室发现一瓶标签残缺的硫酸镁溶液.为了测定此溶液的溶质质量分数,他取出25g该溶液,向其中逐滴加入溶质质量分数为10%的NaOH溶液.反应过程中生成沉淀的质量与所用NaOH溶液质量的关系如图所示.试求: (2008?金城江区)某同学在实验室发现一瓶标签残缺(如图所示)的溶液.为了测定此溶液的溶质质量分数,他取出20g该溶液,向其中逐滴加入溶质质量分数为15%的MgSO4溶液,反应过程中生成沉淀的质量与所用MgSO4溶液质量的关系如图所示.请计算此溶液的溶质质量分数.
(2008?金城江区)某同学在实验室发现一瓶标签残缺(如图所示)的溶液.为了测定此溶液的溶质质量分数,他取出20g该溶液,向其中逐滴加入溶质质量分数为15%的MgSO4溶液,反应过程中生成沉淀的质量与所用MgSO4溶液质量的关系如图所示.请计算此溶液的溶质质量分数.