题目内容
某一氧化碳和二氧化碳组成的混合气体,先通过灼热的氧化铜粉末充分反应,消耗了7.95g氧化铜,再将剩余气体通过足量的澄清石灰水,充分反应后,生成沉淀20g,则原混合气体中二氧化碳气体的质量为多少克?______ Cu+CO279.5 44
7.95g y
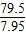 =
=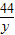
y=4.4克,
所以原混合气中二氧化碳为:8.8-4.4=4.4克,
答:原混合气中二氧化碳为8.8-4.4=4.4克.
【答案】分析:根据题中的叙述列出方程式,根据沉淀的质量计算出二氧化碳的质量,根据氧化铜计算出一氧化碳的质量,
解答:解:设生成20g的沉淀需要二氧化碳的质量为x,
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
x 20g
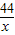 =
=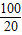
x=8.8克
设消耗7.95克的氧化铜会生成二氧化碳质量为y,
CuO+CO Cu+CO2
Cu+CO2
79.5 44
7.95g y
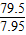 =
=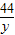
y=4.4克,
所以原混合气中二氧化碳为:8.8-4.4=4.4克,
答:原混合气中二氧化碳为8.8-4.4=4.4克.
点评:在解此类题时,先分析题中的数据之间的关系,然后根据题意列出方程式进行求解,最后进行总结.
解答:解:设生成20g的沉淀需要二氧化碳的质量为x,
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
x 20g
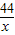 =
=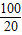
x=8.8克
设消耗7.95克的氧化铜会生成二氧化碳质量为y,
CuO+CO
 Cu+CO2
Cu+CO279.5 44
7.95g y
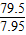 =
=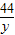
y=4.4克,
所以原混合气中二氧化碳为:8.8-4.4=4.4克,
答:原混合气中二氧化碳为8.8-4.4=4.4克.
点评:在解此类题时,先分析题中的数据之间的关系,然后根据题意列出方程式进行求解,最后进行总结.

练习册系列答案
相关题目