题目内容
写出下列反应的化学方程式,并在括号里注明反应的基本类型:(1)稀硫酸除铁锈 ,反应;
(2)正常雨水的pH≈5.6 ,反应;
(3)铝丝浸入硫酸铜溶液中 ,反应;
(4)氨气在加热条件下与氧化铜反应生成铜、水和空气中含量最多的气体. .
【答案】分析:(1)铁锈的主要成分为氧化铁,硫酸与氧化铁的反应符合“两种化合物相互交换成分,生成另外的两种化合物”;
(2)正常雨水显酸性,是因为二氧化碳与水反应生成碳酸,反应符合“多变一”的特点;
(3)铝的金属活动性比铜的强,故铝能把硫酸铜中的铜置换出来,反应符合“单质和化合物反应生成新单质和新化合物”;
(4)由题意知:反应物为氨气和氧化铜,生成物为铜、水、氮气(空气中含量最多的气体).
解答:解:(1)由题意Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,反应符合“两种化合物相互交换成分,生成新的两种化合物”故为复分解反应;
(2)由题意CO2+H2O=H2CO3,反应符合“多变一”的特点,故为化合反应;
(3)由题意2Al+3CuSO4=Al2(SO4)3+3Cu,反应符合“单质和化合物反应生成新单质和新化合物”,故为置换反应;
(4)由题意知反应物、生成物,故化学方程式为2NH3+3CuO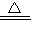 3Cu+3H2O+N2
3Cu+3H2O+N2
故答为:(1)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,复分解反应;
(2)CO2+H2O=H2CO3;化合反应;
(3)2Al+3CuSO4=Al2(SO4)3+3Cu;置换反应;
(4)2NH3+3CuO 3Cu+3H2O+N2
3Cu+3H2O+N2
点评:根据题意,正确书写化学方程式,掌握四种基本反应类型的反应特征及四种反应类型的评定方法.
(2)正常雨水显酸性,是因为二氧化碳与水反应生成碳酸,反应符合“多变一”的特点;
(3)铝的金属活动性比铜的强,故铝能把硫酸铜中的铜置换出来,反应符合“单质和化合物反应生成新单质和新化合物”;
(4)由题意知:反应物为氨气和氧化铜,生成物为铜、水、氮气(空气中含量最多的气体).
解答:解:(1)由题意Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,反应符合“两种化合物相互交换成分,生成新的两种化合物”故为复分解反应;
(2)由题意CO2+H2O=H2CO3,反应符合“多变一”的特点,故为化合反应;
(3)由题意2Al+3CuSO4=Al2(SO4)3+3Cu,反应符合“单质和化合物反应生成新单质和新化合物”,故为置换反应;
(4)由题意知反应物、生成物,故化学方程式为2NH3+3CuO
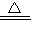 3Cu+3H2O+N2
3Cu+3H2O+N2故答为:(1)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,复分解反应;
(2)CO2+H2O=H2CO3;化合反应;
(3)2Al+3CuSO4=Al2(SO4)3+3Cu;置换反应;
(4)2NH3+3CuO
 3Cu+3H2O+N2
3Cu+3H2O+N2点评:根据题意,正确书写化学方程式,掌握四种基本反应类型的反应特征及四种反应类型的评定方法.

练习册系列答案
相关题目
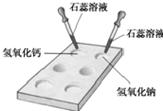
(2009?娄底)小黎同学为了进一步加深对“碱的化学性质”的理解,特邀你协助完成下列活动与探究:
(1)如图所示,在白色点滴板上进行实验,请将实验现象填入下表:
(2)回忆检验二氧化碳气体的反应,写出该反应的化学方 程式______.
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式______.
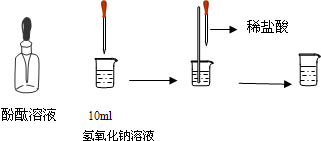
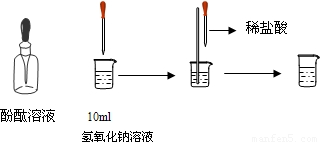
(4)如图所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液,溶液显______色,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止.这一实验说明:酸与碱作用生成了盐和水,这一反应叫做______反应.
(5)根据上面的实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质.(任写两点)?
①______
②______.
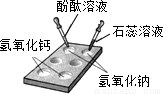
(1)如图所示,在白色点滴板上进行实验,请将实验现象填入下表:
| 氢氧化钠溶液 | 氢氧化钙溶液 | |
| 加紫色石蕊溶液 | ______ | ______ |
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式______.
(4)如图所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液,溶液显______色,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止.这一实验说明:酸与碱作用生成了盐和水,这一反应叫做______反应.
(5)根据上面的实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质.(任写两点)?
①______
②______.